近日,本实验室张智红教授团队提出了一种时空顺序注射抗体法(spatiotemporal sequential injection of antibodies, STSI-Ab法),实现了小鼠肝脏淋巴管网络的活体选择性标记,绘制了小鼠肝脏淋巴管的精细三维结构图谱。进而,建立的肝脏脉管抽离后细胞分选法,实现了肝脏淋巴管内皮细胞的高效分选与深度转录组测序,解析了肝脏淋巴管内皮细胞在肝纤维化和胆汁淤积过程中的转录组信息和潜在功能。研究成果以“Three-dimensional mapping of hepatic lymphatic vessels and transcriptome profiling of lymphatic endothelial cells in healthy and diseased livers”为题发表在Theranostics上。

肝脏被认为是最重要的淋巴液生成器官,通过胸导管的淋巴液中,有25%~50%来源于肝脏。肝硬化动物的肝脏淋巴量增加30倍,而且伴随着新淋巴管的生成。然而,由于缺乏肝脏淋巴管特异性的分子标志物或选择性标记方法,肝脏淋巴管的三维精细结构和空间分布特点仍不清晰,生理病理情况下肝脏淋巴内皮细胞的分子信息也有待丰富。目前,最常用于淋巴管内皮细胞成像的标志物包括标记LYVE-1、Pdpn、Prox1和VEGFR-3,但现有淋巴管内皮细胞标志物均不能特异性标记肝脏淋巴管,因为LYVE-1和Prox1还分别在肝血窦内皮细胞和肝实质细胞中表达,而Pdpn和VEGFR-3在胆管和肝脏血管上表达。近几年单细胞测序研究也未能鉴定出肝脏淋巴管内皮细胞特异性标志物。因此,要了解肝脏淋巴管网络的结构与功能,首先需要对其进行特异性标记,结合合适的样本处理方案和显微成像技术,以展示其整体和精细结构;其次需要发展高效获取肝脏淋巴管内皮细胞的方法,以揭示其在生理病理情况下的分子信息和潜在功能。
针对肝脏淋巴管内皮细胞无法特异性标记这个问题,团队人员深入分析肝脏血管、淋巴管、胆管和肝脏脉管外间隙的空间位置关系,在不同时间、不同部位注射抗体,建立了一种时空顺序注射抗体的方法(如图1A),实现了小鼠肝脏淋巴管内皮细胞的选择性标记(如图1B-D),为揭示肝脏淋巴管的三维结构和空间分布提供了技术手段。
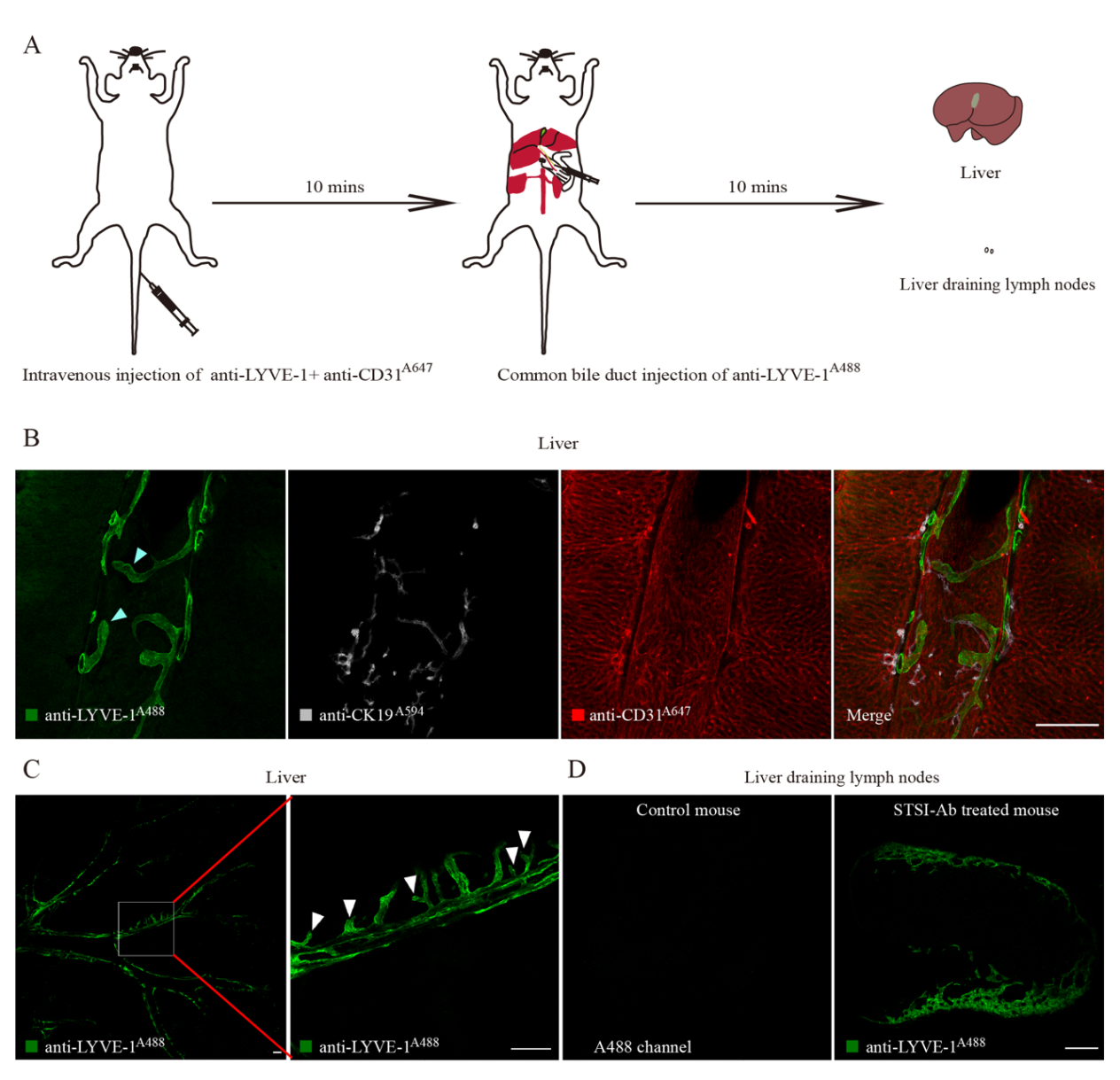
图1 STSI-Ab法选择性标记肝脏淋巴管。(A)STSI-Ab法实验流程示意图。(B)小鼠肝脏振动切片免疫荧光成像展示淋巴管(anti-LYVE-1A488)、血管(anti-CD31A647)和胆管(anti-CK19A568)。(C)小鼠肝脏振动切片全景成像展示淋巴管空间分布。(D)小鼠肝脏引流淋巴结切片成像。标尺:200 μm。
针对肝脏淋巴管三维精细结构和空间分布特点不清晰的问题,团队人员利用荧光显微成像结合组织光透明方法(图2A),展示了STSI-Ab法标记的小鼠完整肝叶淋巴管网络。三维成像结果显示,肝脏具有一套密集分布在门静脉周围的淋巴管(图2B,2D中的绿色脉管),肝脏淋巴管伴随且缠绕门静脉(图2C,2D中的蓝色脉管),而肝静脉附近没有淋巴管(图2C,2D中的红色脉管)。肝脏淋巴管网络具有高度分支的特点,锯齿状的毛细淋巴管沿着门静脉延伸且包裹着门静脉。这些淋巴管形成了一个形状独特的脉管网络,其精细的分支结构与巧妙的空间布局,为容纳和引流肝脏大量的淋巴液提供了结构基础。成像结果清晰展示了淋巴管网络的精细三维结构,明确了其空间分布,即除了门静脉周围,在肝脏其他位置未见淋巴管。基于此,团队人员提出了小鼠肝小叶“四联管”结构模型(图2E),即小鼠肝脏淋巴管存在于汇管区,与门静脉、肝动脉、胆管一起,形成“四联管”结构。
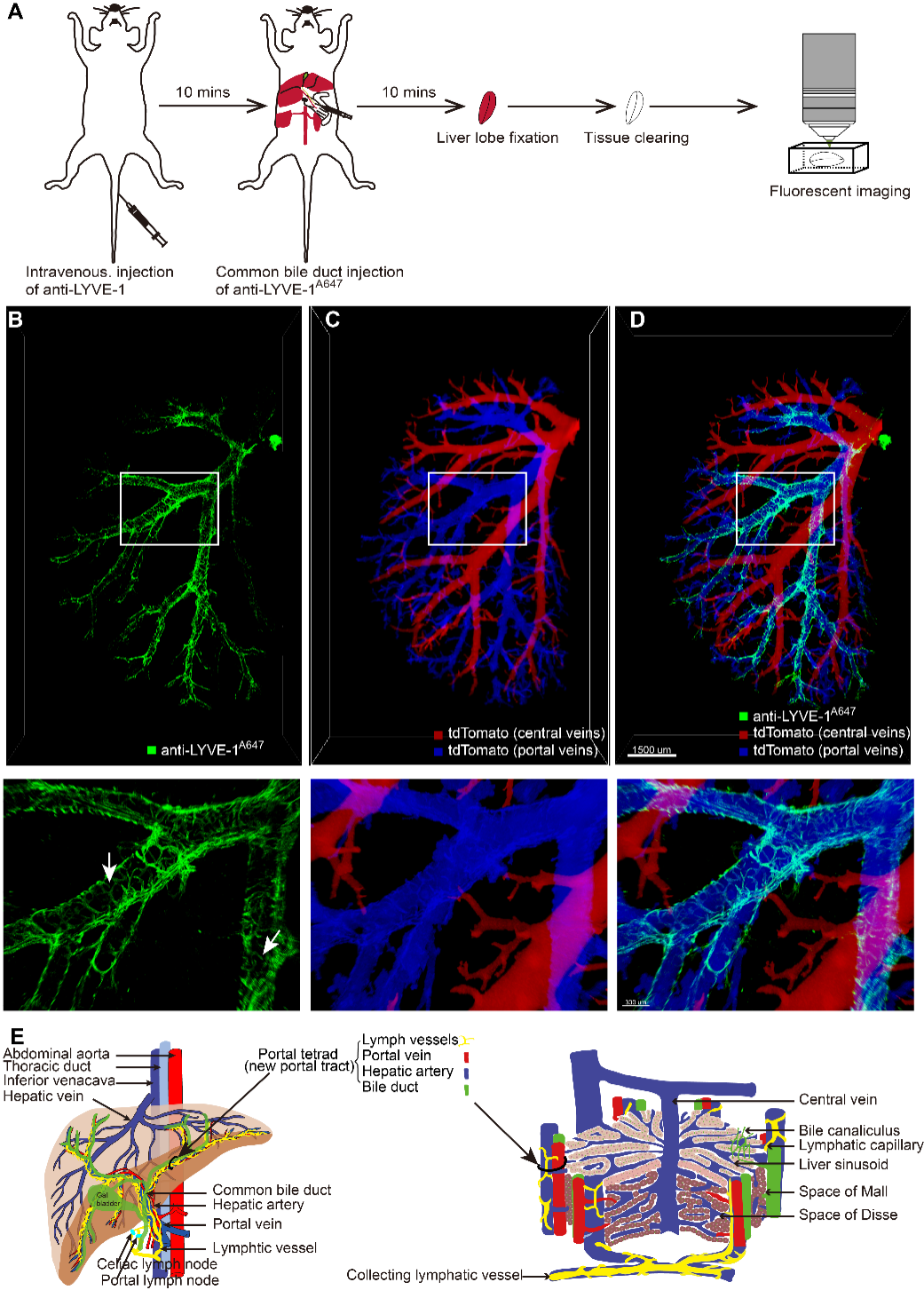
图2 小鼠完整肝叶内淋巴管网络的三维图谱。(A)小鼠肝叶淋巴管三维显微成像流程图。(B-D)绿色脉管代表小鼠肝脏淋巴管,蓝色脉管代表门静脉,红色脉管代表中央静脉。下面三张图像分别是上面三张图像中白色框中的放大图像。白色箭头指示毛细淋巴管的盲端结构。(E)新的肝脏脉管示意图,新的肝小叶结构示意图。
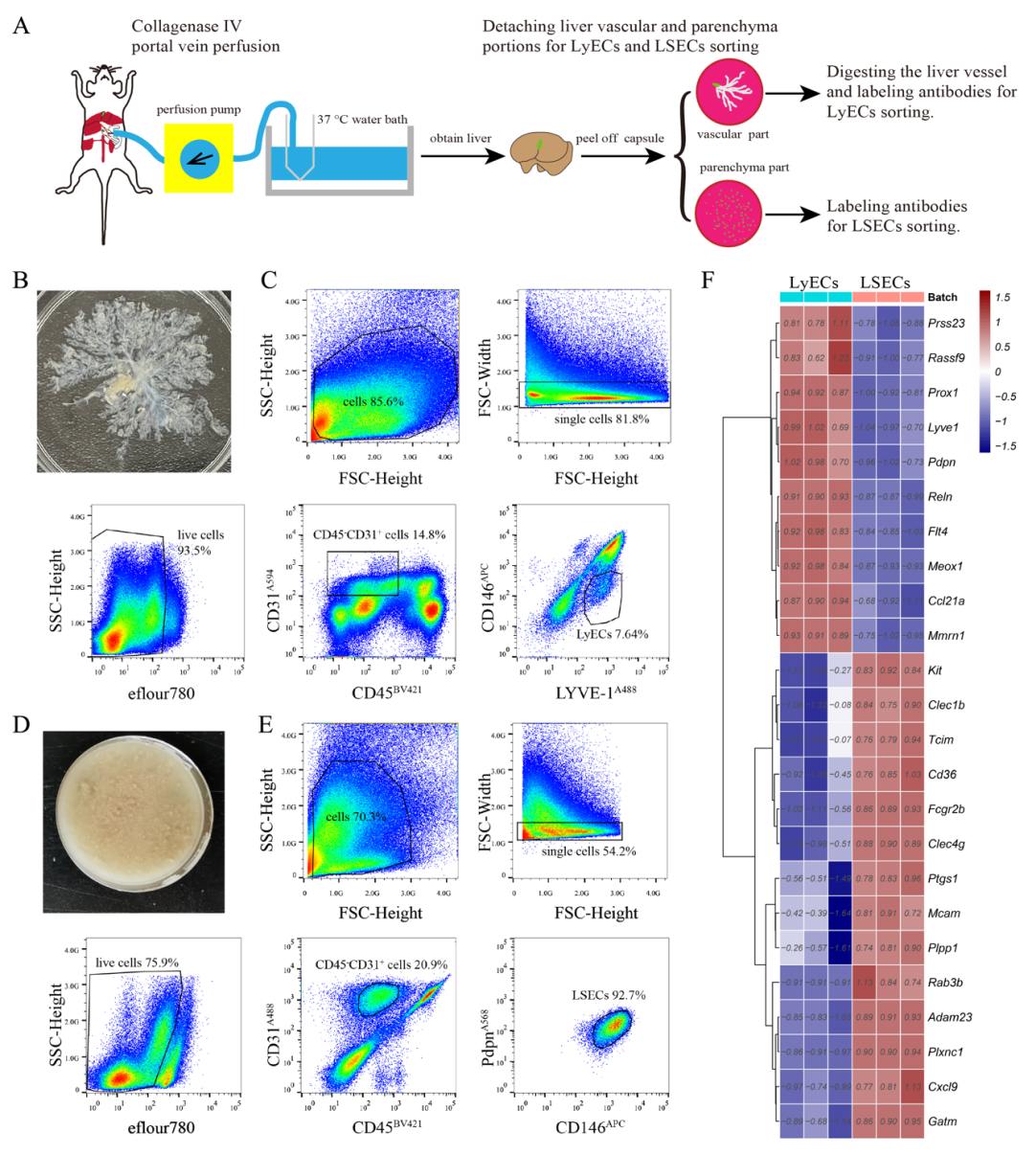
图3. 基于小鼠肝脏脉管抽离后分选法的肝脏淋巴管内皮细胞高效分选与深度转录组测序。(A)小鼠肝脏脉管抽离后分选法的实验流程示意图。(B-C) 从肝脏脉管部分获得淋巴管内皮细胞的流式分选策略。(D-E) 从肝脏实质部分获得肝血窦内皮细胞的流式分选策略。(F)热图展示淋巴管内皮细胞和肝血窦内皮细胞标志基因的表达水平。LyECs:淋巴管内皮细胞(lymphatic endothelial cells)。LSECs:肝血窦内皮细胞(liver sinusoid endothelial cells)。
受小鼠肝脏淋巴管分布在门静脉附近这个特点的启发,团队人员通过门静脉灌流胶原酶Ⅳ消化肝脏,事先抽离肝脏主要脉管部分(图3A),以达到提升肝脏淋巴管内皮细胞在流式分选上样时细胞数量占比的目的(图3B-E)。该方法使淋巴管内皮细胞在单细胞悬液中的比例增加了两个数量级(约100倍)。这种样本制备方法明显缩短了肝脏淋巴管内皮细胞的分选时长,有利于保持细胞活性并用于后续转录组测序(图3F)。基于此方法,对小鼠肝脏淋巴管内皮细胞进行深度转录组测序,分析这一细胞群体在正常、肝纤维化、非酒精性脂肪肝炎和胆汁淤积中的转录组变化。转录组测序结果显示了一种很有趣的变化趋势,与正常小鼠相比,Col5a1和 Col6a3等细胞外基质基因在肝纤维化和胆汁淤积小鼠的肝脏淋巴管内皮细胞中上调(图4A)。Masson染色结果也验证了这一变化,在肝纤维化和胆汁淤积小鼠的门静脉区域有胶原纤维沉积(图4B)。考虑到肝脏淋巴管定位在门管区,而且临床慢性肝病患者肝脏门管区会出现纤维化沉积物,提示肝脏淋巴管内皮细胞可能是肝纤维化和胆汁淤积进程中肝脏门管区沉积的胶原纤维的重要来源。
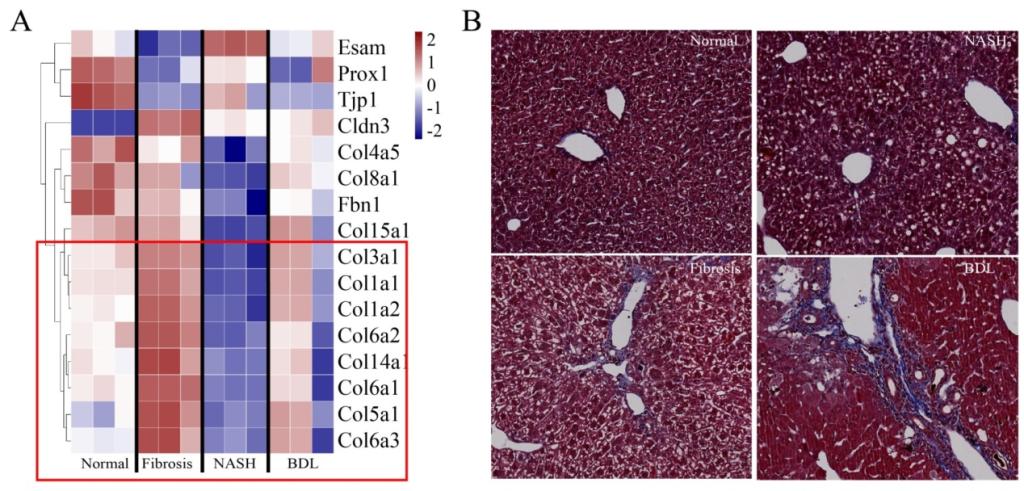
图4 肝脏淋巴管内皮细胞可能在肝纤维化和胆汁淤积过程中产生胶原纤维。(A)正常、肝纤维化、非酒精性脂肪肝炎和胆汁淤积小鼠肝脏淋巴管内皮细胞的代表性基因表达热图。(B)正常、CCl4诱导肝纤维化、非酒精性脂肪肝炎和胆汁淤积小鼠的肝脏切片Masson成像结果。
该研究丰富了人们对肝脏淋巴管精细三维结构和淋巴管内皮细胞分子信息的认识,将有助于肝脏疾病病理过程及淋巴循环相关机制的探究。
18luck新利电竞
武汉光电国家研究中心张智红教授和海南大学骆清铭院士为文章的共同通讯作者,课题组研究生黄松林、栗博睿和刘征为文章的共同第一作者,课题组成员徐梦丽、林栋、胡佳红、潘奇共同参与了相关工作。
参考文献:
Songlin Huang, Borui Li, Zheng Liu, Mengli Xu, Dong Lin, Jiahong Hu, Dongjian Cao, Qi Pan, Jing Zhang, Jing Yuan, Qingming Luo*, Zhihong Zhang*. Three-dimensional mapping of hepatic lymphatic vessels and transcriptome profiling of lymphatic endothelial cells in healthy and diseased livers. Theranostics, 13(2): 639-658, 2023.
原文链接:https://www.thno.org/v13p0639.htm